1 – Les Liquides Ioniques
i – Structure des LIs
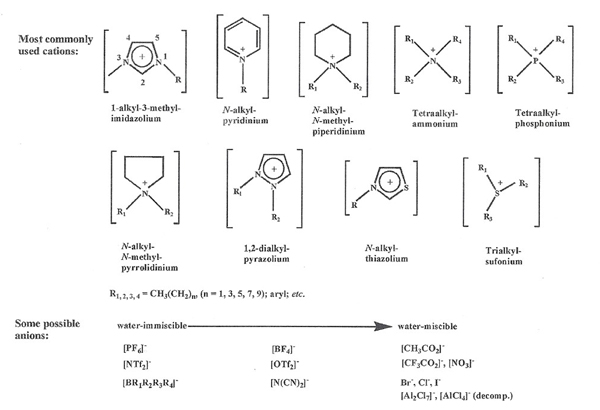
Les liquides ioniques (LIs) sont des composés bien connus de la communauté des physico-chimistes et des chimistes organiciens. Liquides à des températures inférieures à 100 °C et composés exclusivement d’ions, ces sels fondus se présentent généralement sous la forme d’un cation organique volumineux de type alkylimidazolium, alkylpyridinium, alkylpyrrolidinium, alkylammonium ou alkylphosphonium et d’un contre-ion minéral tel que le chlorure, l’iodure, l’hexafluorophosphate ou le tetrafluoroborate, ou alors un contre-ion organique comme un carboxylate, le trifluorométhanesulfonylimide ou encore l’alkylsulfonate. La possibilité de combiner des anions et des cations différents (on dénombre jusqu’à 1018 combinaisons possibles) permet une grande variété de propriétés physiques et physico-chimiques. Une sélection de ces différentes combinaisons est représentée Figure 1.
Figure 1. Cations et Anions les plus utilisés pour former des LIs [1]
ii – Historique des LIs
Le premier liquide ionique, le nitrate d’éthylammonium, a été synthétisé au début du siècle dernier, mais c’est réellement dans les années soixante-dix que les liquides ioniques ont commencé à être synthétisés pour des applications électrochimiques dans le domaine des batteries. Dans les années 80, une nouvelle classe de LIs, basée sur les sels d’imidazolium, a émergé mais leur association aux anions aluminochlorates, très réactifs avec l’air et l’eau, a limité leur développement. Ce n’est qu’au début des années 90, après la synthèse de LIs imidazolium associés à des anions fluorés, stables à l’air et à l’eau, que les liquides ioniques ont suscité l’intérêt des chercheurs [2].
iii – Propriétés des LIs
Les structures et interactions moléculaires complexes dans les LIs conduisent à des propriétés chimiques et physico-chimiques remarquables et à un énorme potentiel d’applications dans des procédés (synthèse, catalyse, séparations) et dispositifs (optique, batteries, lubrification).
Les propriétés chimiques des liquides ioniques comme leur polarité élevée et les propriétés physiques comme leur stabilité thermique élevée, leur rhéologie, leur pouvoir solvant ainsi que leur basse pression de vapeur au-dessous de la température de décomposition (négligeable à la température ambiante) permettent d’envisager leur utilisation dans divers domaines d’applications. Les lIs sont des solvants aux extraordinaires propriétés conduisant à une augmentation de la réactivité et de la sélectivité pour diverses réactions chimiques.
A l’échelle moléculaire, les LIs sont caractérisés par une structuration nanométrique avec la coexistence de domaines non-polaires (interactions de type van der Waals) et des régions polaires (interactions électrostatiques). Cette nanostructuration a été mise en évidence par simulation moléculaire [3] mais aussi par des études spectroscopiques, de diffraction de rayons X ou par des mesures calorimétriques [4]. La dissolution de solutés apolaires, polaires ou associatifs peut être expliquée à l’échelle moléculaire [5]: les solutés apolaires sont solvatés dans les zones formées par les chaînes alkyle apolaires ; les solutés polaires interagissent avec les régions apolaires et les têtes chargées et sont donc souvent totalement miscibles avec les LIs. Les solutés associatifs sont capables d’établir des interactions spécifiques avec les LIs (par exemple, des liaisons hydrogène) conduisant à des solutions structurées.
De nombreuses réalisations industrielles font usage des LIs tels que le procédé DifasolTM (1995, IFP-Axens), le procédé BASILTM(2003, BASF). Ces procédés ont prouvé que les lIs peuvent être employés à la place des solvants organiques conventionnels, décriés pour leur nocivité environnementale, dans beaucoup de réactions comme par exemple celles impliquant des systèmes catalytiques, dans les procédés d’extraction des métaux, dans le domaine nucléaire, de la contamination de l’eau [6], etc. En électrochimie, les LIs sont également très utilisés en tant qu’électrolytes pour l’électrodéposition de métaux sur des surfaces conductrices [7].
2 – Les Liquides Ioniques : Agents multifonctionnels pour les Polymères
i – Liquide ionique : Un milieu réactionnel pour la synthèse et la modification des polymères
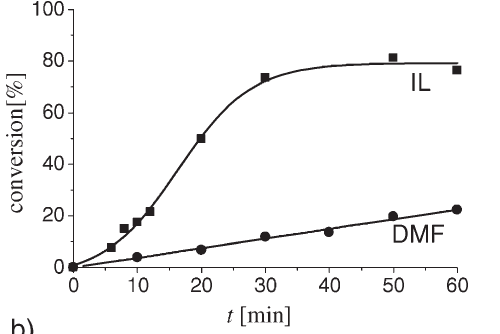
Une application relativement récente des liquides ioniques est leur utilisation en tant que solvant de polymérisation comme alternative aux solvants organiques conventionnels [8]. Le nombre de publications à ce sujet reste cependant limité. L’amélioration combinée à des taux de polymérisation et des masses molaires accrues décrite pour la plupart des procédés de polymérisations étudiés en milieu liquide ionique (radicalaire conventionnelle [9] et contrôlée [10], anionique/cationique [11], par coordination [12]) montre l’efficacité de ces solvants LIs sur les processus de polymérisation comme le montre par exemple la Figure 2 relative à la conversion du méthacrylate de méthyle [13].
Figure 2. Influence du solvant sur le taux de conversion de la polymérisation radicalaire
du méthacrylate de méthyle avec Il = [EMIm][EtHSO4–] et DMF : diméthylformamide [13]
Les coefficients de taux de propagation KP très élevés et la réduction de l’énergie d’activation de propagation Ea dans ces milieux peuvent s’expliquer par l’existence de liaisons hydrogène entre les monomères et les chaînes de polyméthylméthacrylate en croissance d’une part et les cations et les anions des lIs d’autre part.
Quelques exemples de polymérisation de monomères solubles dans des LIs comme les monomères méthacrylate (hydroxyéthylméthacrylate), styrène, acrylate, acétate de vinyle, acrylonitrile, etc dans des liquides ioniques aprotiques à base de sels N-dialkylimidazolium associés à des anions fluorés type [PF6–], [BF4–] ou [N(SO2CF3)2] ont été étudiés. Les LIs utilisés dans les polymérisations en suspension jouent aussi le rôle de surfactant pour les particules de polymères synthétisées (polystyrène [14], particules conductrices [15]). Par la nature chimique et la taille du cation et de l’anion et par le choix de sa fonctionnalisation (longueur et concentration des chaînes aliphatiques), le LI permet de stabiliser et diminuer le diamètre des particules de polymères jusqu’à des diamètres sub-nanométriques. Les LIs sont également efficaces pour solubiliser les polymères naturels et permettre des modifications chimiques. Ainsi l’acétylation ou d’autres estérifications sont alors possibles sur les dérivés saccharidiques comme le Guar lorsqu’elles sont réalisées dans le chlorure d’allylméthylimidazolium.
ii – Liquide ionique : Une aide à la mise en œuvre des polymères
La capacité des LIs à solubiliser de nombreuses substances comme les sels, les substances grasses, les protéines, les acides aminés, les oligo- et polysaccharides en fait un solvant de choix par leur forte polarité et le caractère accepteur de liaisons hydrogène de leurs anions. Le premier brevet sur la dissolution de la cellulose par un LI ammonium date ainsi de 1934. Depuis cette date, les LIs ont été utilisés pour solubiliser d’autres biopolymères comme le bois, la soie, la kératine ou d’autres polysaccharides comme le guar [16-17]. Les interactions LI/LI sont contrebalancées au profit des interactions LI/Polymère par le choix adapté de la combinaison cation/anion du LI. Les diagrammes de phase solide-liquide sont dictés par la nature chimique du LI qui peut modifier la solubilité du polymère et influer sur la température de solubilisation [18].
Les LIs sont également de bons substituts des plastifiants traditionnels dans les polymères comme l’acide polylactique (PLLA), le polyméthacrylate de méthyle (PMMA) ou le polychlorure de vinyle (PVC) [19-20].
Les LIs sont également des agents compatibilisants efficaces pour favoriser la dispersion de charges organiques ou inorganiques dans une matrice polymère et élaborer ainsi des nanocomposites à morphologie contrôlée. Dans les nanocomposites à nanocharges lamellaires, l’échange cationique réalisé avec des LIs type pyridinium, imidazolium ou phosphonium améliore la stabilité thermique des nanocharges et permet la mise en œuvre à l’état fondu de nanocomposites polymères/argiles [21]. Les LIs aident également à la stabilisation et au contrôle de taille des nanoparticules métalliques [22]. L’adsorption du LI sur la nanoparticule est dépendante de la fonction portée par le LI, ionique vs silylée ou thiol vs aromatique générant respectivement des interactions ioniques sur les silicates lamellaires [23], covalentes sur les groupements hydroxyle des oxydes comme la silice ou sur une surface d’or [24] ou interactions P-P sur les nanotubes de carbone [25].
iii – Liquide ionique : Un agent de (nano)structuration des polymères
Le LI peut également jouer le rôle d’un agent (nano)structurant du polymère et conduire à l’élaboration de gels physiques ou chimiques dont l’obtention est schématisée Figure 3 [22]. L’association de LIs à des polymères électrolytes soit directement par polymérisation à partir d’un LI réactif (monomère) [26] soit par solubilisation du polymère électrolyte dans le LI [27] représente une excellente alternative aux électrolytes très fortement décriés en termes de sécurité puisque souvent inflammables et volatils comme les liquides utilisés dans la fabrication des batteries au lithium et des super capacités [28]. Ces membranes dont la plage d’utilisation a été élargie grâce au caractère thermostable des liquides ioniques et qui présentent des propriétés électrochimiques adaptées si le liquide ionique est bien choisi peuvent également être d’excellents candidats pour les piles à combustibles [29]. La grande versatilité des LIs permet à ces ionogels de répondre à de larges applications électrochimiques en favorisant la conductivité ionique, protonique ou électronique par la nature du LI et son association au polymère [30].
Figure 3. Schématisation de la structuration d’un gel électrolyte après insertion d’un LI dans un réseau macromoléculaire [22]
La versatilité que présentent les liquides ioniques par la nature du cation, de l’anion et des ligands organiques en fait des objets fonctionnels à interactions variables avec la matrice polymère capables de générer une structuration dans le polymère. Les séparations de phase générées dans le matériau entre le LI et la matrice, induisent des structurations différentes desdomainesioniques dansla matrice polymère depuis l’échelle micrométrique à l’échelle nanométrique comme le montrent les clichés de microscopie électronique à transmission reportés sur la Figure 4 [31]. Ainsi,des morphologiesco-continuesà un réseau percolant (spider web)peuvent être générées en fonction de la nature de l’anion ou du cation. Les liquides ioniques se comportent alors comme un réseau de cations et d’anions associés par des interactions ioniques donnant lieu à des nœuds physiques dans la matrice avec des propriétés similaires aux ionomères sans toutefois posséder les nombreux inconvénients que nécessite la synthèse de ces derniers.
Figure 4. Structurations variables en fonction de la nature du contre anion associé
à l’octadécylphosphonium dispersé à hauteur de 1% en poids dans une matrice fluorée [31]
iv – Liquide ionique : Pour des matériaux polymères fonctionnels
Les LIs par la fonctionnalisation qu’ils portent peuvent conduire à de nombreux matériaux fonctionnels (gels photopolymérisables [32], particules de latex [33], films thermoplastiques [34] ou réseaux thermodurcissables [35], membranes électrolytiques [36], matériaux intelligents thermosensibles [18]). Les LIs introduits dans les matériaux polymères offrent une nouvelle voie pour relever le challenge récurrent qui est en science des matériaux de concevoir et de créer de nouveaux polymères présentant des améliorations de leurs propriétés physiques et des combinaisons de comportements (polymères multifonctionnels). Des premiers travaux montrent le potentiel de ces nouveaux agents multifonctionnels pour améliorer les propriétés thermiques et mécaniques de ces matériaux polymères [34]. Par leur forte conductivité ionique et par les modifications induites sur la matrice en terme de structuration et de cristallinité, les propriétés électriques, diélectriques et barrière à la diffusion des gaz peuvent être également impactées ce qui offre de nouvelles perspectives dans le domaine de l’énergie et des membranes de piles à combustible. D’autres domaines de comportements physiques peuvent également être concernés comme par exemple la grande capacité des LIs à réduire le coefficient de frottement et l’usure des polymères contre les métaux [37].
Les liquides ioniques apparaissent donc comme des composés versatiles, simples à synthétiser avec des propriétés très attractives ce qui leur vaut le qualificatif de composés « magiques ». Ils représentent de nombreuses alternatives aux solvants organiques volatils ainsi qu’aux électrolytes conventionnels. Les liquides ioniques ouvrent aussi la voie à de nouvelles chimies (chimie supramoléculaire, modifications chimiques) menées dans de nouveaux milieux de polymérisation avec une plus grande efficacité et une plus grande pureté (capacité des LIs à dissoudre de nombreux types de systèmes catalytiques). La capacité des liquides ioniques à structurer et fonctionnaliser les matériaux polymères depuis l’échelle nanométrique permet d’envisager l’élaboration de nouveaux matériaux (nanomatériaux, membranes électrolytes, matériaux poreux, …) qui ouvrent de larges perspectives industrielles dans les domaines de l’énergie, des matériaux de structure et des biomatériaux. Ce développement prometteur doit motiver (et motive déjà) la recherche académique et industrielle sur la compréhension des interactions LIs/polymères et des relations structure-propriétés résultantes de l’association LIs/polymères.
Références
[1] N. V. Plechkova, K. R. Seddon, Chem. Soc. Rev. (2008); 37:123.
[2] J.S.Wilkes, J.A. Levisky, R.A.Wilson, C.L. Hussey, Inorg. Chem. (1982); 22:1263; A.A. Fannin, D.A. Floreani, L.A. King, J.S. Landers, B.J. Piersma, D.J. Stech, R.L. Vaughn, J.S. Wilkes, J.L. Williams, Part 2, J. Phys. Chem. (1984); 88:2614.
[3] Canongia Lopes, J. N.; Pádua, A. A. H., J. Phys. Chem. B (2006); 110 :3330 ; Urahata, S. M.; Ribeiro, M. C. C. J. Chem. Phys. (2004); 120 :1855 ; Wang, Y.; Voth, G. A. J. Am. Chem. Soc. (2005); 127: 12192.
[4] Hu, Z.; Margulis, C. J. Proc. Nat. Acad. Sci. (2006); 103 : 831 ; Triolo, A.; Russina, O.; Bleif, H.-J.; Di Cola, E. J. Phys. Chem. B (2007); 111: 4641.
[5] Canongia Lopes, J. N.; Costa Gomes, M. F.; Pádua, A. A. H. J. Phys. Chem. B (2006); 110, 16816; Padua, A.A.H., Costa Gomes, M.F., Canongia Lopes, J.N.A. Acc. Chem. Res. (2007); 40: 1087.
[6] P. Wasserscheid, W. Keim, Angew. Chem. (2000); 112: 3926; R.A. Bartsch, S. Chun, S.V. Dzyuba, American Chemical Society, Washington, DC, (2002); 58; S. Chun, S.V. Dzyuba, R.A. Bartsch, Anal. Chem. (2001); 73:3737.
[7] P. Wasserscheid, T. Welton, Ionic Liquids in Synthesis, Wiley-VCH, Weinheim, Germany, (2003).
[8] K. J. Thurecht, P. N. Gooden, S. Goel, C. Tuck, P. Licence, D. J. Irvine, Macromolecules (2008); 41: 2814.
[9] Zhang, H.; Hong, K.; Mays, J. W., Macromolecules (2002); 35: 5738.
[10] Sung Chul Hong, Tadeusz Pakula and Krzysztof Matyjaszewski, Macromol. Chem. Phys., (2001); 202: 3392.
[11] Hong HL, Zhang HW, Mays JW, Visser AE, Brazel CS, Holbrey JD,, MacFarlane. Chem Com. (2002); 2226.
[12] Kubisa, Prog. Polym Sci. (2004); 29: 3.
[13] G. Schmidt-Naake, I. Woecht, A. Schmalfu, T. Gluïck Macromol. Symp. (2009); 204.
[14] Minami, H., Tarutani, Y., Yoshida, K. and Okubo, M. Macromol Rapid Com. (2008); 29:567
[15] H. Yabu, A. Tajima, T. Higuchi, M. Shimomura,. Chem. Commun. (2008); 4588.
[16] Y. Fukaya, A. Sugimoto, and H. Ohno, Biomacromolecules, (2006); 7: 3295.
[17] Kuang J. Phys. Chem. B (2008); 112 : 10234.
[18] Takeshi Ueki and Masayoshi Watanabe, Macromolecules (2008); 41: 11
[19] K. Park and M. Xanthos, Polym. Degrad. Stab., (2009); 94 : 834.
[20] M. Rahman and C.S. Brazel, Prog. Polym. Sci., (2004); 29 : 1223.
[21] S. Livi, J. Duchet-Rumeau, T. N. Pham and J-F. Gérard, Journal of Colloid and Interface Science, (2010); 349 (1) : 424.
[22] Y. V. Smetannikov, A. A. Zanin, Russ. Chem. Rev. (2010) ; 79 : 463
[23] S. Livi, J. Duchet-Rumeau, J-F. Gérard, Journal of Colloid and Interface Science, (2011); 353 (1) : 225.
[24] Lee, B. S.; Chi, Y. S.; Lee, J. K.; Choi, I. S.; Song, C. E.; Namgoong, S. K.; Lee, S. J. Am. Chem. Soc. (2004); 126 : 480.
[25] Liang, C. D., Huang, J. F., Li, Z. J., Luo, H. M., and Dai, S. Eur. J. Org. Chem. (2006); 586.
[26] Ohno, H. Electrochim. Acta, (2001); 46:1407.
[27] Fuller, J.; Breda, A. C.; Carlin, R. T. J. Electroanal. Chem. (1998); 459:29.
[28] Liao KS., Sutto TE., Andreoli E., Ajayan P., McGrady K.A., Curran S.A. Journal of Power Sources (2010) ; 195: 867.
[29] Martinez M., Molmeret Y., Cointeaux L., Iojoiu C., Leprêtre J.C., N. El Kissi, P. Judeinstein , J.Y. Sanchez. Journal of Power Sources, (2010); 195(18): 5829.
[30] P. Wang, S.M. Zakeeruddin, I. Exnar, M. Grätzel, Chem. Comm. ;. (2002) ; 2972.
[31] S. Livi, J-F. Gérard, J. Duchet-Rumeau, Chemical communications (2011) ; 47: 3589.
[32] H. Ohno, Macromol. Symp. (2007); 249 :551
[33] F. Yan , J. Texter , Chem. Comm. (2006); 2696
[34] S. Livi, J. Duchet-Rumeau, T. N. Pham and J-F. Gérard, Journal of Colloid and Interface Science, (2011); 354 (2) : 555.
[35] B.G. Soares, S. Livi, J. Duchet-Rumeau, J-F. Gérard, Macromolecular Materials and Engineering, (2011); 296 (9): 826.
[36] Susan, M. A.; Kaneko, T.; Noda, A.; Watanabe, M. J. Am. Chem. Soc. (2005);127: 4976.
[37] J. Sanes, F. J. Carrión, M. D. Bermúdez, Wear (2010); 268 : 1295.